3. Sorptiegedrag van Chroom.
3.1. Inleiding
Chroom is in 1797 ontdekt in het mineraal krokiet
(PbCrO4). De naam is afgeleid van het Griekse woord 'chroma'
wat kleur betekent. Chroom heeft een atoomgewicht van 51.996
en heeft een electronen schil configuratie van 3d54s1. Dit
betekent dat chroom in verschillende oxidatietoestanden kan
voorkomen. In het milieu zijn twee van deze oxidatietoestanden
stabiel: Cr(III) en Cr(VI). Hiervan is Cr(VI) giftig voor
organismen, en dus ook voor de mens (Nriagu & Nieboer, 1988).
Cr(III) daarentegen, is een essentieel bestanddeel van de
menselijke voeding (Underwood, 1981).
Industrieel wordt chroom gebruikt om roestvorming in
staal tegen te gaan (roestvrij staal is staal met meer dan 10
% chroom). Chroomzouten en -oxiden worden onder andere
gebruikt in leerlooierijen, verven en pigmenten. Jaarlijks
komt door deze industriële activiteiten 1350 ton Cr in het
milieu terecht (Slooff et al., 1989).
In aquatische milieu's kunnen Cr(III) en Cr(VI) als
verschillende species voorkomen. Het aantreffen van een
bepaalde verdeling is vooral afhankelijk van de pH en de Eh.
Verder spelen de aanwezigheid van bepaalde oxiderende en
reducerende stoffen, evenals de kinetiek van de redoxreacties,
een rol. Bij grotere chroom concentraties worden onoplosbare
Cr(III)-zouten gevormd.
De speciatie van Cr(VI) is eenvoudig. Bij toenemende pH
splitst het H2CrO4 molecuul steeds een proton af; er worden dus
negatief geladen species gevormd (zie figuur 1). Cr(VI) vormt
geen complexen met anorganische of organische liganden
(Nieboer & Jusys, 1988). Het dichromaation (Cr2O72-) komt niet in
het milieu voor bij chroom concentraties lager dan 500 ppm.
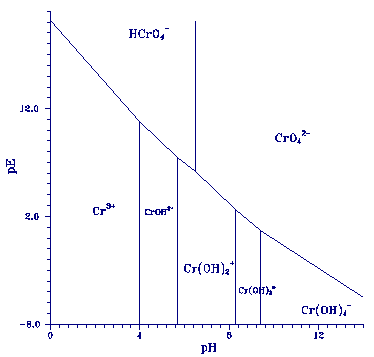
Figuur 1.
pE-pH evenwichts diagram voor 10-8 M Cr in water. K-waarden volgens Baes & Mesmer
(1976) zijn gebruikt. Er is geen
rekening gehouden met organische complexen.
In tegenstelling tot Cr(VI) komt Cr(III) als positief
geladen ion in het aquatisch milieu voor. Afhankelijk van de
pH vormt Cr(III) complexen met organische liganden zoals
carboxylzuren, humuszuren en fulvozuren (James & Bartlett,
1983a). Van de anorganische liganden vormt Cr(III) voornamelijk
complexen met OH- (zie figuur 1). Alle andere complexen
(met onder andere sulfaat en fluoride) blijken in verwaarloosbare
kleine concentraties in zeewater voor te komen (Elderfield, 1970). In rivierwater zullen
deze complexen zich dan
ook niet vormen, bijzondere omstandigheden uitgezonderd. Het
onoplosbare Cr(OH)3 (s) is een belangrijke sink voor chroom.
In dit onderzoek is de adsorptie van Cr(III) en Cr(VI)
bestudeerd. Gekeken is naar adsorptie aan ijzerhydroxide,
illiet en Rijnslib, al dan niet in combinatie met mangaan-
oxide. Een belangrijk aspect is de complexvorming met humuszuur en de invloed hiervan
op de adsorptie eigenschappen. Deze
complexvorming blijkt een belangrijke bijdrage te leveren aan
de concentratie opgelost Cr(III) onder natuurlijke omstandigheden (Yamazaki et al., 1980;
Nakayama et al., 1981b). De
experimenten zijn uitgevoerd in een electrolyt-oplossing (pH =
7.85) en in zeewater. Dit om de invloed van de ionsterkte op
de adsorptie te bepalen.
3.2. Materialen en methoden
3.2.1. Materialen
Hetzelfde Rijnslib is gebruikt als dat van de experimenten van Comans en Van Dijk
(1988). Het gesuspendeerde materiaal is verzameld in oktober 1987 in een doorstroom
centrifuge,
nabij Lobith, waar de Rijn Nederland binnen komt. De centrifuge bevat teflon platen waar
het gesuspendeerde materiaal op
verzameld wordt. Het materiaal is afgeschraapt met een teflon
spatel en bewaard bij 4½C in het donker. De chemische en
mineralogische samenstelling is onder andere bestudeerd door
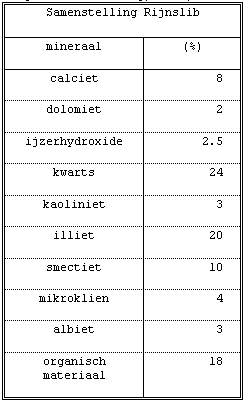
Van der Weijden & Middelburg (1989). De samenstelling van het
materiaal is gegeven in tabel II.
Kunstmatig rivier water (electrolyt) bestaat uit Ca2+,
HCO3- als natuurlijke buffer en NO3- met een ionsterkte van 3 *
10-3 M en een pH van 7.8. Suspensies zijn geëquilibreerd met
electrolyt gedurende twee weken. Als zeewater wordt puur Noord
Atlantisch zeewater gebruikt (saliniteit = 35), wat verzameld
is op 56-00-01 NB en 02-20-29 OL op een diepte van 50 meter
onder het wateroppervlak. Dit water bevat zeer lage concentratie nutriënten, zware
metalen en gesuspendeerd materiaal.
Cr(NO3)3±2 H2O (Merck, suprapur) is gebruikt om de begin
concentraties Cr(III) aan te leggen. K2CrO4 (Merck, suprapur)
is gebruikt voor de begin concentraties Cr(VI).
Voor de scheiding tussen de vaste en de vloeibare fase is
gecentrifugeerd in een high-speed-centrifuge (2 * 104 m/s2). In
het algemeen geeft centrifugeren betere resultaten dan filtratie.
De gamma-activiteit van het 51Cr-supernatant is geteld met
een 1281 CompuGamma (LKB-Wallac, Finland) gamma-teller met
NaI-detector (1 ml monster, teltijd 7200 seconden).
De temperatuur is constant gehouden op 20½C þ 1½C gedurende alle handelingen.
Een 51CrCl3 tracer in 0.1 M HCl (37 MBq, 1 mCi) is gebruikt als Cr(III) tracer
(Amersham, Houten). Als Cr(VI)
tracer is natriumchromaat in een waterige oplossing gebruikt
(37 MBq, 1 mCi, Amersham, Houten).
3.2.2. Methoden
Wandadsorptie. Voor zowel Cr(III) als Cr(VI) wordt een concentratie
aangemaakt van 5 en 250 Ìg Cr voor Cr(III) en 5 en
100 Ìg Cr voor Cr(VI). Deze wordt toegevoegd aan de reactievaten, eppendorf cupjes en
glazen buizen om de bijdrage van de
adsorptie aan de vaten te kunnen meten. Om vorming van neerslag te bepalen, wordt ook
nog gecentrifugeerd.
Sorptie aan suspensies
. Aan electrolyt-oplossing en zeewater
worden eerst Cr(III) concentraties (5, 25, 50, 100 en 250 Ìg/l
Cr(III)) toegevoegd. Daarna wordt illiet (0.1 g/l) en ijzerhydroxide (0.01 g/l) toegevoegd.
Na adsorptie van Cr(III) is
geprobeerd om het Cr weer te desorberen met: (1) natuurlijk
zeewater (organisch rijk); (2) natuurlijk Noordzee water
(Noordwijk, 2, 2 km uit de kust); (3) rivierwater (meetstation
Vuren); (4) NTA (10 mg/l); (5) mangaanoxide.
Voor Cr(VI) (5 en 100 Ìg/l) zijn alleen adsorptie ex-
perimenten uitgevoerd.
Sorptie met humuszuur. Na de experimenten zonder humuszuur
(humuszuur natriumzout mp > 300 ½C, Aldrichchemie, Steinheim
Germany) is besloten om Cr(III) zowel als Cr(VI) te incuberen
met humuszuur en vervolgens na 24 uur aan de suspensie toe te
voegen. In zoet en zeewater wordt een 50 ppm humuszuur concentratie aangelegd.
Daaraan wordt na 24 uur een suspensie toegevoegd: 0.01 g/l ijzerhydroxide, 0.1 g/l
Rijnslib of 0.1 g/l
illiet. Adsorptie is vervolgens gedurende 12 dagen gevolgd.
In het geval van Cr(III) is nog extra mangaanoxide (10
ppm) aan de suspensie toegevoegd.
In appendix A (tabel A1 tot en met A84) staan de afzonderlijke experimenten
vermeld.
3.3. Resultaten en discussie
3.3.1. Wandadsorptie van Cr(III) en Cr(VI)
Het is algemeen bekend dat kationen adsorberen aan
reactievaten waarin een experiment wordt uitgevoerd. Van der
Weijden & Reith (1982) gebruikten dit fenomeen om de adsorptiesnelheid te bepalen van
Cr(III) bij verschillende pH's en
ionsterkten. Bij pH waarden van 7.8 en 8.1, waarden die ook in
dit onderzoek gebruikt zijn, blijkt na vier weken bijna 100 %
(= 100 Ìg/l) geadsorbeerd te zijn. Daarom is hier in eerste
instantie de adsorptie bekeken van Cr(III) en Cr(VI) aan
verschillende soorten teflon. Voor Cr(VI) is ook de adsorptie
aan andere materialen bepaald.
De resultaten van
Cr(III) adsorptie zijn ge-
geven in Appendix A, tabel
A1 tot en met A16. Adsorptie aan PFA (Per Fluor
Alkoxy) en PTFE (Poly Tetra
Fluor Ethyleen) treedt al
vrij snel op. Na 5 uur is
al minimaal 10 % van het
toegevoegde Cr(III) geadsorbeerd. Dit percentage
loopt op met toenemende
tijd. Adsorptie aan PFA is
duidelijk minder dan aan
PTFE, zowel in zeewater als
in een electrolyt-oplossing
(zie figuur 2).
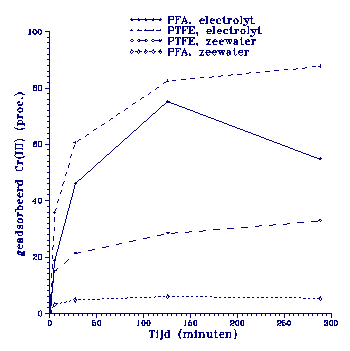
Figuur 2.
Adsorptie gedrag van Cr(III) aan twee soorten teflon. De initiele Cr(III) concentratie is
250 ppb.
De hoeveel-
heid geadsorbeerd Cr(III),
aan met name PTFE, lijkt
groter dan de hoeveelheden
die adsorberen aan onder
andere polyethyleen (Shendrikar & West, 1974). Over
een vergelijkbaar tijdinterval wordt een maximum
adsorptie gevonden van 270 ppb. De initiële Cr(III) concentratie was 1 ppm, vier
keer zo hoog als in dit onderzoek. In
zeewater is de geadsorbeerde hoeveelheid, vooral bij hogere
concentraties Cr(III), minder.
De oplossingen zijn ook gecentrifugeerd, zodat de adsorptie aan de centrifuge cupjes
(de zogenaamde Eppendorf
cupjes, gemaakt van polyethyleen) bepaald kan worden. Er
treedt inderdaad adsorptie op aan de cupjes, want de Cr(III)
concentraties in oplossing na centrifugeren zijn significant
lager dan de concentraties voor centrifugeren. De hoeveelheid
Cr(III) die aan de cupjes adsorbeerd wordt uitgedrukt in een
zogenaamde Cd-waarde, die de verhouding geeft tussen het aantal
ppb Cr wat aan de cupjes adsorbeert, en het aantal ppb Cr dat
in oplossing zit. Deze waarde is dimensieloos. Bij lage
Cr(III) concentraties blijkt de Cd-waarde voor PFA en PTFE, in
zowel electrolyt-oplossing als zeewater, zeer laag te zijn
(zie tabel I).
Tabel I.
Cd waarden voor de adsorptie van Cr(III) aan Eppendorf cupjes.
Cd = Cr aan wand (ppb) / Cr in oplossing (ppb).
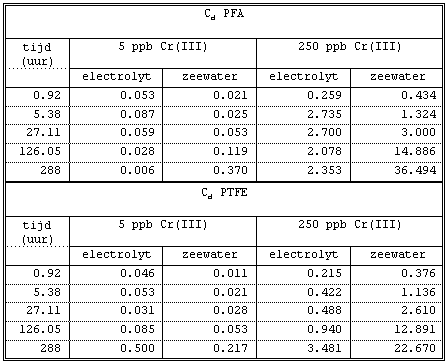
Bij hogere concentraties Cr(III) neemt de Cd met
de tijd toe. Vooral in zeewater is dit zeer duidelijk het
geval. Waarschijnlijk is dit niet alleen aan adsorptie te
wijten, maar speelt ook neerslag van Cr(OH)3 (s) (of een andere
vaste fase) een rol. Anders is het niet te verklaren dat meer
dan 200 ppb Cr(III) uit de oplossing verdwijnt in 35 minuten.
Waarom er een neerslag ontstaat is niet duidelijk. De concentratie Cr(III) is laag genoeg
om het vormen van neerslagen
te voorkomen. Tijdens het centrifugeren zou een pH groter dan
9 moeten ontstaan om precipitatie van Cr(OH)3 (s) te krijgen.
Tijdens de uitvoering van de experimenten is geen neerslag
geconstateerd.
Bij de experimenten met gesuspendeerd materiaal is het
verlies van Cr(III) in de centrifugecupes en aan de wanden van
het teflon klein. De initiële Cr(III) concentraties zijn
maximaal 100 ppb en snelle adsorptie aan de suspensie treedt
op (zie 3.2 en 3.3). De concentratie Cr(III) in oplossing is
dan zo klein dat slechts een klein gedeelte aan de wand van de
teflon pot zal adsorberen. Ook adsorptie in de centrifuge
cupjes zal dan gering zijn zoals uit tabel I blijkt.
Voor de adsorptie resultaten van Cr(VI) wordt verwezen
naar tabel A17 - A36. Indien een totale procedure fout van 5 %
wordt aangenomen, dan blijkt dat adsorptie van chromaat niet
of nauwelijks optreedt. Het materiaal (PTFE, FEP (fluor copolymeer van ethyleen en
propyleen, vergelijkbaar met PFA),
Eppendorf cupje, plastic (polyethyleen) en glas) en het medium
(electrolyt-oplossing en zeewater) zijn niet van invloed. Deze
resultaten zijn in overeenstemming met de resultaten van
Shendrikar & West (1974).
Alle volgende experimenten zijn uitgevoerd in PFA vaten.
3.3.2. Adsorptie van Cr(III) aan model substraten en Rijnslib
Twee algemeen voorkomende materialen zijn onderzocht op
hun adsorptievermogen voor wat betreft Cr(III), het kleimineraal illiet en ijzerhydroxide.
Dit is gedaan door
verschillende concentraties Cr(III) aan suspensies van illiet en
ijzerhydroxide toe te voegen. De resultaten zijn gegeven in
tabel A37 - A42.
Na 0.17 dagen (= 4 uur) blijkt vrijwel alle Cr(III)
geadsorbeerd te zijn. Dit geldt voor alle concentraties voor
zowel ijzerhydroxide als illiet. Het adsorberende species bij
de experimentele pH (± 7.8) is Cr(OH)2+ (zie figuur 1). Vervolgens is gekeken of
Cr(III) weer gedesorbeerd kan worden.
Hiervoor zijn verschillende dingen uitgeprobeerd. Allereerst
is geprobeerd of organisch materiaal, in de vorm van humuszuur
en NTA, het organisch materiaal los kan krijgen A37, A38 en
A42). Het is bekend dat organische liganden complexen kunnen
vormen met Cr(III) (Yamazaki et al., 1980; Nakayami et al.,
1981b). Hier blijkt dat deze organische materialen niet in
staat zijn Cr(III) van illiet of ijzerhydroxide los te maken.
De volgende poging tot desorptie is het verhogen van de
ionsterkte door toevoeging van zeewater (A37, A40 en A42). Ook
dit heeft geen effect, alle Cr(III) blijft geadsorbeerd. Ook
een combinatie van humuszuur en zeewater (A39) heeft geen
desorptie tot gevolg. Het zal duidelijk zijn dat rivierwater
(A40) ook geen Cr(III) desorbeert. Uit een studie van Calmano
en Lieser (1981) blijkt dat toevoeging van NaCl aan een suspensie van slib, geen invloed
heeft op het sorptiegedrag van
Cr(III). Cr(III) wordt dus niet gemobiliseerd tijdens de
overgang van een zoet naar een zout water milieu.
Tenslotte is nog mangaanoxide toegevoegd. Mangaanoxiden
zijn in staat om Cr(III) te oxideren naar Cr(VI) (Nakayama et
al., 1981a,c; Van der Weijden & Reith, 1982; Eary & Rai,
1987), waarna Cr(VI) in oplossing komt. In de suspensie met
illiet (A41) lijkt dit proces te verlopen: na 35 dagen is 7 %
desorbeerd. Met de hier gebruikte meetmethode is niet te zeggen of dit gedesorbeerde
chroom drie- of zeswaardig is. Het is
echter aannemelijk dat dit Cr(VI) is wat in de oplossing is
terecht gekomen. De oxidatiereactie verloopt volgens Van der
Weijden & Reith (1982) via de volgende stappen: (1) adsorptie
van Cr(III) aan mangaanoxide; (2) oxidatie aan het oppervlak;
(3) desorptie van Cr(VI). Hier zou dan desorptie van illiet
aan vooraf moeten gaan. De suspensie met ijzerhydroxide (A41)
laat geen afname van de hoeveelheid geadsorbeerd Cr(III) zien.
Blijkbaar is de binding met ijzerhydroxide sterker dan de
binding met illiet.
Op basis van bovenstaande experimenten zijn nog een
aantal experimenten uitgevoerd. Mangaanoxide en humuszuur worden nu samen met
Cr(III) aan de suspensies toegevoegd.
Ook is
de adsorptie aan Rijnslib bekeken. De resultaten staan in
A43 - A53.
Wat direct opvalt is dat adsorptie in de electrolytoplossing met humuszuur veel
langzamer gaat dan wanneer geen
humuszuur is toegevoegd (A43 en A44). Dit is eenvoudig te
verklaren. Cr(III) en humuszuur vormen neutrale en negatief
geladen complexen van verschillende molecuulgewichten (Yamazaki et al., 1980).
Adsorptie aan negatief geladen kleimineralen en metaaloxiden wordt dan moeilijk. Deze
complexen blijven
maximaal tien dagen stabiel (Yamazaki et al., 1980). Na een
bepaalde tijd valt een organo-Cr(III) complex dus uiteen. Het
Cr(III) komt dan weer in oplossing. Complexatie kan met een
een ander humuszuur molecuul kan dan optreden. Een andere
mogelijkheid is dat het Cr(III) adsorbeert aan het substraat.
Eerdere experimenten hebben aangetoond dat deze adsorptie
reactie zeer snel optreedt. Aangezien de hoeveelheid geadsor-
beerd Cr(III) met de tijd blijft toenemen, is het aannemelijk
dat bovenstaand proces inderdaad verloopt. Dit betekent dat de
organo-Cr(III) complexen alleen een vertragende werking op de
adsorptie hebben. Dat de adsorptiesnelheid bepaald wordt door
het uiteenvallen van de organo-Cr(III) complexen, wordt bevestigd door het vrijwel gelijk
zijn van de geadsorbeerde
hoeveelheden voor ijzerhydroxide en illiet. In zeewater (A48 en
A49) adsorbeert ongeveer 50 % van het Cr(III) binnen 4 uur,
waarna ongeveer hetzelfde beeld zichtbaar wordt als in de
electrolyt-oplossing (zie
figuur 3).
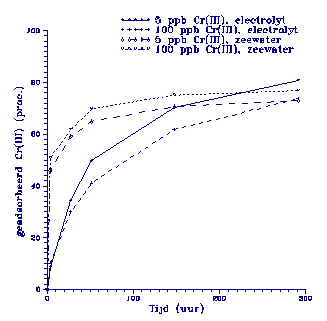
Figuur 3.
Adsorptie gedrag van Cr(III) aan een suspensie van illiet in aanwezigheid van humuszuur
(50 ppm).
Blijkbaar worden
in zeewater minder organoCr(III) complexen gevormd,
zodat in eerste instantie
een grote hoeveelheid anorganisch Cr(III) geadsor-
beerd wordt. Mantoura et
al. (1978) hebben aangetoond dat humuszuur in zee-
water voor meer dan 99 %
complexeert met Ca en Mg.
Na deze snelle adsorptie
van anorganisch Cr(III)
wordt de adsorptiesnelheid
weer bepaald door de uiteenvallende organo-Cr(III)
complexen.
Een andere verklaring
voor de toenemende adsorptie in de tijd is adsorptie
van de organo-Cr(III) complexen aan de wand van het reactievat. Gezien de resultaten
van de wandadsorptie experimenten met chromaat (zie 3.1), is
dit echter niet waarschijnlijk. De lagere hoeveelheden geadsorbeerd Cr in de
electrolyt-oplossing (waar aanvankelijk meer
organo-Cr(III) complexen aanwezig zijn) wijzen ook niet in die
richting.
Dat de experimenten in zeewater en electrolyt-oplossing
dezelfde resultaten opleveren, is iets wat niet te verwachten
is. In het algemeen wordt adsorptie namelijk minder bij toenemende ionsterkten. Mayer &
Schick (1981) dragen hier de vol-
gende redenen voor aan: (1) grotere competitie met andere
ionen; (2) afname van de activiteitscoëfficiënt verlaagt de
reactiviteit; (3) verlaging van de reactiviteit door complexatie of ionpaar vorming. De
laatste reden gaat voor chroom niet
op, want Cr(III) vormt in zeewater geen andere complexen dan
in zoet water.
Uit de vorige experimenten kwam al naar voren dat Cr(III)
zeer sterk gebonden zit aan illiet ijzerhydroxide. Deze sterke
binding is het gevolg van de grote oppervlaktelading van het
Cr(III)-ion, die weer veroorzaakt wordt door de kleine ionstraal (0.63 * 10-10 m). De
adsorptie drang is zo hoog dat
vrijwel alle andere kationen in zeewater verdrongen worden van
de adsorptieplaatsen. Ook de andere experimenten bevestigen
dit.
Wanneer een suspensie van illiet of ijzerhydroxide samen
met mangaanoxide, in een electrolyt-oplossing, wordt ingezet,
treedt weer snelle adsorptie op (A45 en A46). Voor de lage
Cr(III) concentratie (5 ppb) lijkt na 27 uur een licht afname
op te treden in de hoeveelheid geadsorbeerd chroom, met name
bij ijzerhydroxide. Dit wordt veroorzaakt door de oxidatie van
Cr(III) door het mangaanoxide. In vergelijking met experimenten
zonder mangaanoxide,
lijkt ongeveer 15 % van
het Cr(III) te zijn
omgezet. Voor de 100
ppb concentratie gaat
dit niet op, vrijwel
alle Cr(III) adsorbeert. Er zijn drie
oorzaken aan te dragen
waarom nu geen Cr(III)
wordt geoxideerd. Het
kan zo zijn dat andere
kationen specifiek aan
MnO2 adsorberen en zodoende de beschikbare
adsorptieplaatsen ver-
minderen. Dit is in een
electrolyt-oplossing
niet waarschijnlijk.
Verder zou er te weinig
mangaanoxide aanwezig
kunnen zijn, zodat oxidatie maar op zeer
kleine schaal verloopt. Tenslotte zou de kinetiek van de
reactie te langzaam kunnen zijn. De laatste oorzaak gaat niet
op. Van der Weijden & Reith (1982) hebben experimenten gedaan
met 10 keer zo veel mangaanoxide en vinden een oxidatie van 50
% van het Cr(III) na 300 uur. Alle andere experimentele omstandigheden zijn min of
meer gelijk. Bij deze experimenten is
dus te weinig mangaanoxide aan de suspensie toegevoegd (10
ppm) om significante hoeveelheden geoxideerd chroom te krijgen.
Tenslotte is naar de adsorptie aan Rijnslib gekeken (A47
en A52, zie figuur 4). De samenstelling van het Rijnslib is
gegeven in tabel II.
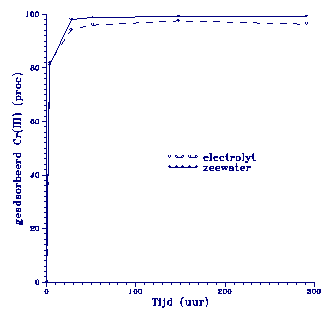
Figuur 4.
Adsorptiegedrag van Cr(III) aan Rijnslib (0.099 g/L). De initiele Cr(III) concentratie is
100 ppb.
Dit levert een bekend beeld op: snelle
adsorptie van vrijwel alle Cr(III) en geen verschil tussen de
electrolyt-oplossing en zeewater. Adsorptie oppervlak is ruim
voorhanden in Rijnslib: bijna 40 % bestaat uit kleimineralen
en dan zijn er ook nog ijzerhydroxiden en carbonaten (zie
tabel II). Blijkbaar worden geen organo-Cr(III) complexen
gevormd, hoewel 18 % van
het slib uit organisch
materiaal bestaat. Dit
houdt in dat het organisch
materiaal deel uit maakt
van de vaste fase (bijvoorbeeld als coating om kor-
rels). Het organisch materiaal kan zo wel bijdragen
aan de adsorptiecapaciteit
van het slib. Mangaanoxiden
zijn in te lage hoeveelheden aanwezig om Cr(III)
te kunnen oxideren.
Uit alle experimenten
blijkt dat het zeer moei-
lijk is om Cr(III) in oplossing te houden. Alleen
humuszuren zijn hiertoe
door complexvorming in
staat. Als het Cr(III) eenmaal geadsorbeerd is, is
het zeer moeilijk om het,
onder natuurlijke condities, weer van het substraat te verwijderen.
Tabel II.
Samenstelling van Rijnslib (Van Eck, 1982: Van der Weijden & Middelburg, 1989).
3.3.3. Adsorptie van Cr(VI) aan model substraten en Rijnslib
Dezelfde experimenten als bij de Cr(III) adsorptie zijn
uitgevoerd. De resultaten zijn gegeven in A53 - A84.
In eerste instantie is gekeken naar het adsorptiegedrag
van Cr(VI) aan ijzerhydroxide, illiet en Rijnslib, in zeewater
en in een electrolyt-oplossing. IJzerhydroxiden hebben een
Point of Zero Charge (PZC) dat ligt bij pH = 8.5. Adsorptie
van anionen kan dus over een breed pH-traject optreden. De ex-
perimenten in de electrolyt-oplossing (A53 en A54) laten maar
een geringe adsorptie van chromaat zien. Dit is waarschijnlijk
te wijten aan de hoge experimentele pH (± 7.7). Aangezien de
adsorptie pH-afhankelijk is (Zachara et al, 1987), heeft het
hydroxide oppervlak nog maar een
kleine positieve lading. Dit wordt
duidelijk gemaakt in figuur 5.
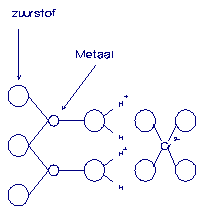
Figuur 5.
Schematische voorstelling van geadsorbeerd chromaat als outer-sphere complex (Hays,
1987).
Bij
toenemende pH splitsen steeds meer
H+-ionen af van het (hydr)oxideoppervlak. De positieve lading van
het oppervlak maakt op die manier
plaats voor negatieve lading. In
zeewater (A71 en A72) is adsorptie
afgenomen tot bijna niets door
onder andere competitie met andere
anionen.
Adsorptie van Cr(VI) aan illiet en Rijnslib in een electrolyt-
oplossing (A55 - A58) is beduidend
minder dan adsorptie aan ijzerhydroxide. Hier is een eenvoudige
verklaring voor te geven. Kleimineralen bestaan uit negatief geladen platen en alleen de
randen van die platen hebben een
positieve lading. Het adsorptie oppervlak voor anionen is dus
klein en adsorptie wordt ook nog bemoeilijkt door de afstotende werking van de negatieve
platen. Dit verklaart tevens de
lage adsorptie capaciteit van het Rijnslib, dat voor ongeveer
40 % uit kleimineralen bestaat (zie tabel II). In zeewater
(A73 - A76) treedt geen adsorptie meer op. Competitie met
andere anionen (vooral eenwaardige) en afname van de reactiviteit doordat de
activiteitscoëfficiënt afneemt, zijn hiervoor
verantwoordelijk (Mayer & Schick, 1981). Ook bij lagere concentraties anionen dan in
zeewater neemt Cr(VI) adsorptie al
af. Zachara et al. (1987) hebben verlaagde adsorptie van
chromaat aangetoond in experimenten met grondwater. Bij lagere
pH's zal adsorptie van chromaat beter gaan. Enerzijds neemt de
positieve oppervlaktelading van het ijzerhydroxide toe, anderzijds wordt het aandeel
HCrO4- groter (zie figuur 1). Adsorptie
van eenwaardige anionen aan kleimineralen is eenvoudiger dan
voor tweewaardige anionen zoals CrO42-.
Vervolgens is mangaanoxide aan de suspensie toegevoegd
(A59 - A70). Hiervoor geldt hetzelfde verhaal als hierboven
beschreven is: de beste adsorptie treedt op aan ijzerhydroxide, illiet en Rijnslib
adsorberen minder. In zeewater is
adsorptie van chromaat vrijwel nul. De geadsorbeerde hoeveelheden
chromaat zijn met en zonder mangaanoxide ongeveer hetzelfde.
Hieruit blijkt dat mangaanoxiden geen chromaat adsorberen. Dit is logisch omdat het PZC
bij een pH ligt van on-
geveer 2.
Tenslotte is nog humuszuur aan de suspensie toegevoegd.
Het doel hiervan is om de reductie van Cr(VI) te bestuderen,
eerder gerapporteerd door Bartlett & Kimble (1976), Nakayama
et al., (1981c) en James & Bartlett (1983b). Voor ijzerhydroxide in de
electrolyt-oplossing (A78) adsorbeert voor de
100 ppb Cr(VI) concentratie inderdaad iets meer Cr. Dit betekent dat slechts een klein
gedeelte van het aanwezige Cr(VI)
gereduceerd wordt naar Cr(III). Het gevormde Cr(III) wordt
direct geadsorbeerd aan het substraat. Voor de kleine hoeveelheid omgezet chromaat zijn
twee oorzaken aan te wijzen: (1)
humuszuur is niet het meest geschikte materiaal om chromaat te
reduceren (Nakayama et al., 1981c); (2) bij pH waarden groter
dan 7 neemt reductie van Cr(VI) sterk af (Bartlett & Kimble,
1976; Nakayama et al., 1981c). De andere experimenten in de
electrolyt-oplossing (A79 en A80) laten ook iets hogere waarden voor adsorptie zien in
vergelijking met de experimenten
zonder humuszuur. Dat chromaat reductie op kleine schaal
optreedt, bewijzen ook de experimenten in zeewater (A82 tot en
met A84). Treedt zonder humuszuur geen adsorptie op, met
humuszuur adsorbeert ongeveer 5 %.
Ook deze experimenten bewijzen dat Cr(III) zeer snel uit
de oplossing wordt verwijderd. Wordt in een oplossing Cr
gemeten dan zal dit vrijwel altijd Cr(VI) zijn. Een uitzondering moet worden gemaakt
voor het Cr(III) dat door organisch
materiaal gecomplexeerd is.
3.4. Conclusies
Adsorptie van Cr(III) aan diverse soorten teflon treedt
vrij snel op (binnen 5 uur). Indien geen suspensie aanwezig
is, adsorbeert een aanzienlijk deel van het Cr(III), oplopend
tot bijna 100 % aan PTFE. Ook adsorptie aan de wand van de
centrifuge cupjes is aanzienlijk. Tijdens de adsorptie experimenten aan de verschillende
substraten zullen bovenstaande
processen echter van ondergeschikt belang zijn. Er treedt dan
zo'n snelle adsorptie op aan het substraat, dat de hoeveelheid
Cr(III) die aan het teflon en de centrifuge cupjes kan adsor-
beren, zeer laag is.
Wandadsorptie van Cr(VI) treedt niet op aan de in dit
onderzoek gebruikte materialen.
IJzerhydroxide en illiet adsorberen Cr(III) snel en
volledig tot concentraties van 100 ppb. De binding is zeer
stevig want pogingen tot desorptie, met onder andere humuszuur
en zeewater, lopen op niets uit. Wanneer aan het begin van het
experiment humuszuur wordt toegevoegd, verloopt de adsorptie
veel langzamer. Negatieve en neutrale organo-Cr(III) complexen
vallen uiteen, waarna Cr aan het substraat kan adsorberen of
weer een nieuw organisch complex kan vormen. In zeewater
worden duidelijk minder organo-Cr(III) complexen gevormd dan
in de electrolyt-oplossing door de vorming van humuszuur
complexen met Ca en Mg.
Wanneer mangaanoxide wordt toegevoegd in plaats van
humuszuur, treedt bij lage Cr(III) concentraties een verminderde adsorptie op (± 15 %).
Dit is een gevolg van de oxidatie
van Cr(III) naar Cr(VI) door het mangaanoxide. Bij hogere
Cr(III) concentraties is geen procentuele afname te zien omdat
de hoeveelheid mangaanoxide daarvoor te klein is. In alle
bovenstaande gevallen geldt dat zeewater niet of nauwelijks
van invloed is op de uiteindelijk geadsorbeerde hoeveelheid
Cr(III).
Adsorptie aan Rijnslib van Cr(III) is min of meer hetzelfde als adsorptie aan
ijzerhydroxide en illiet vanwege de
samenstelling van het Rijnslib. Het slib bestaat voor bijna 40
% uit kleimineralen en voor 2.5 % uit ijzerhydroxide. Ook de
18 % organisch materiaal (aanwezig in de vaste fase) draagt
aan de adsorptie bij.
Voor chromaat is adsorptie, als anion, veel moeilijker
dan voor Cr(III), speciaal bij hogere pH waarden. Adsorptie
aan Rijnslib en illiet is duidelijk minder dan aan ijzerhydroxide, doordat ijzerhydroxide
een PZC heeft dat bij pH =
8.5 ligt. Door competitie met andere anionen en verlaging van
de activiteitscoëfficiënt, treedt in zeewater geen adsorptie
op.
Toevoeging van mangaanoxide (PZC bij pH ± 2) heeft geen
invloed op de adsorptie. Wanneer echter humuszuur wordt toegevoegd, neemt de
adsorptie van Cr toe (± 5 %). Verantwoordelijk
hiervoor is de reductie van Cr(VI) naar Cr(III) door het
humuszuur. Het gevormde Cr(III) adsorbeert direct. Dat slechts
een klein deel van het chromaat gereduceerd wordt, wordt
veroorzaakt door de hoge pH en het feit dat humuszuur niet het
meest geschikte materiaal is.
3.5. Referenties
Baes Jr, C.F. & Mesmer, R.E. (1976): The hydrolysis of
cations. Wiley, New York.
Bartlett, R.J. & Kimble, J.M. (1976): Behavior of chromium in
soils: II. Hexavalent forms. Journal of Environmental Quality,
5, 383-386.
Calmano, W. & Lieser, K.H. (1981): Untersuchun der Austausch
Vorgnge von Spurenelementen an Schwebstoffen mit Hilfe der
Radionuklidtechnik. Zeitschrift fr Analytische Chemie, 307,
256-361.
Comans, R.N.J. & Van Dijk, C.P.J. (1988): Role of complexation
processes in cadmium mobilization during estuarine mixing.
Nature, 336, 151-154.
Eary, L.E. & Rai, D. (1987): Kinetics of chromium(III)
oxidation to chromium(VI) by reaction with manganese dioxide.
Environmental Science and Technology, 21, 1187-1193.
Elderfield, H. (1970): Chromium speciation in seawater. Earth
and planetary science letters, 9, 10-16.
Hays, K.F. (1987): Equilibrium, spectroscopic and kinetic
studies of ion adsorption at the oxide/aqueous interface.
Dissertation, Stanford University, CA.
James, B.R. & Bartlett, R.J. (1983a): Behavior of chromium in
soils: V. Fate of organically complexed Cr(III) added to soil.
Journal of Environmental Quality, 12, 169-172.
James, B.R. & Bartlett, R.J. (1983b): Behavior of chromium in
soils: VII. Adsorption and reduction of hexavalent forms.
Journal of Environmental Quality, 12, 177-181.
Mantoura, R.F.C., Dickson, A. & Riley, J.P. (1978): The complexation of metals with
humic materials in natural waters.
Estuarine and Coastal Shelf Science, 6, 387-408.
Mayer, L.M. & Schick, L.L. (1981): Removal of hexavalent
chromium from estuarine waters by model substrates and natural
sediments. Environmental Science and Technology, 15, 1482-
1484.
Nakayama, E., Tokoro, H., Kuwamoto, T. & Fujinaga, T. (1981a):
Dissolved state of chromium in seawater. Nature, 290, 768-770.
Nakayama, E., Kuwamoto, T., Tsurubo, S., Tokoro, H. &
Fujinaga, T. (1981b): Chemical speciation of chromium in
seawater. Part 1: Effect of naturally occurring organic
materials on the complex formation of chromium(III). Analytica
et Chimica Acta, 130, 289-294.
Nakayama, E., Kuwamoto, T., Tsurubo, S. & Fujinaga, T.
(1981c): Chemical speciation of chromium in seawater. Part 2:
Effects of manganese oxides and reducible organic materials on
the redox processes of chromium. Analytica et Chimica Acta,
130, 401-404.
Nieboer, E. & Jusys, A.A. (1988): Biological chemistry of
chromium. In: Chromium in the natural and human environments
(Nriagu, J.O. & Nieboer, E., eds.), Wiley & Sons, 21-79.
Nriagu, J.O. & Nieboer, E. (1988): Chromium in the natural and
human environments. Wiley & Sons, New York.
Shendrikar, A.D. & West, P.W. (1974): A study of adsorption
characteristics of traces of chromium(III) and (VI) on
selected surfaces. Analytica et Chimica Acta, 72, 91-96.
Slooff, W., Cleven, R.F.M.J., Janus, J.A. & Van der Poel, P.
(eds.) (1989): Werkdocument chroom. Rapportnr. 758701001,
R.I.V.M., Bilthoven.
Underwood, E.J. (1971): Trace elements in human and animal
nutrition. Academic Press, New York.
Van der Weijden, C.H. & Middelburg, J.J. (1989):
Hydrogeochemistry of the river Rhine: long term and seasonal
variability, elemental budgets, base levels and pollution.
Water Research, 23, 1247-1266.
Van der Weijden, C.H. & Reith, M. (1982): Chromium(III) -
Chromium(VI) interconversions in seawater. Marine Chemistry,
11, 565-572.
Van Eck, G.J.M. (1982): Geochemistry of suspended particulate
matter and water in the Hollands Diep/Haringvliet. Thesis,
Rijksuniversiteit Utrecht.
Yamazaki, H., Gohda, S. & Nishikawa, Y. (1980): Chemical forms
of chromium in natural water - interaction of chromium(III)
and humic substances in natural water. Journal of the
Oceanographical Society of Japan, 35, 233-340.
Zachara, J.M., Girvin, D.C., Schmidt, R.L. & Resch, C.T.
(1987): Chromate adsorption on amorphous iron oxyhydroxide in
the presence of major groundwater ions. Environmental Science
and Technology, 21, 589-594.



Titel rapport:







